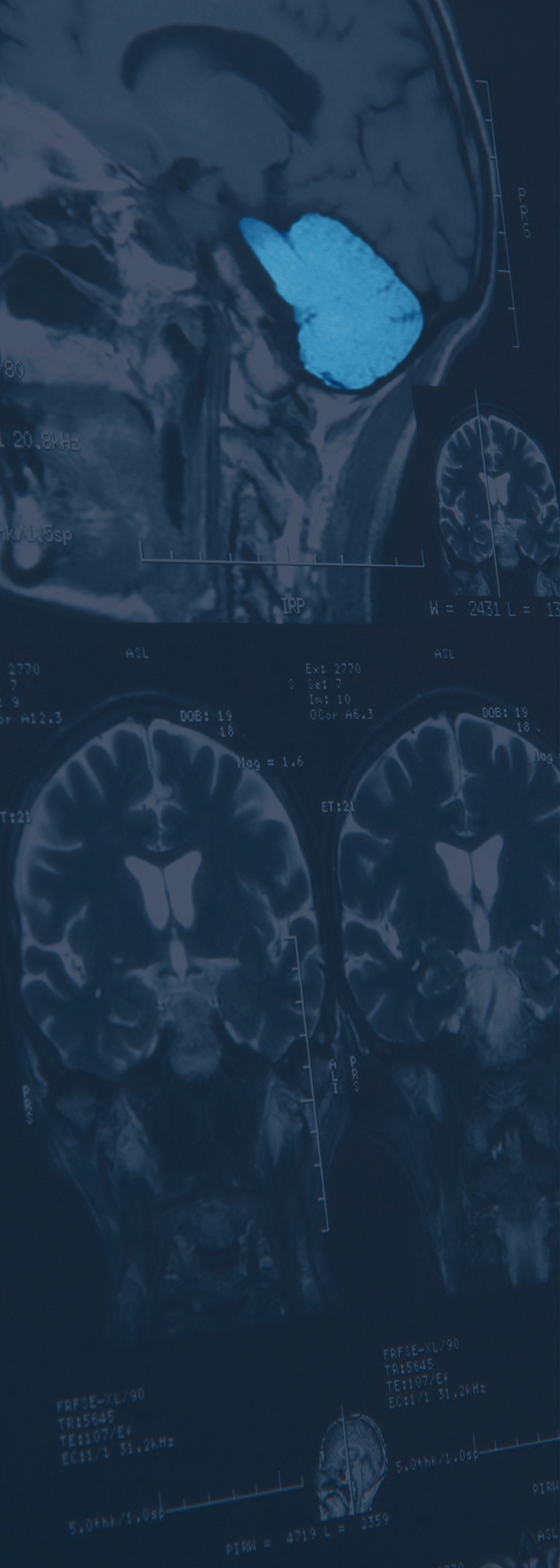
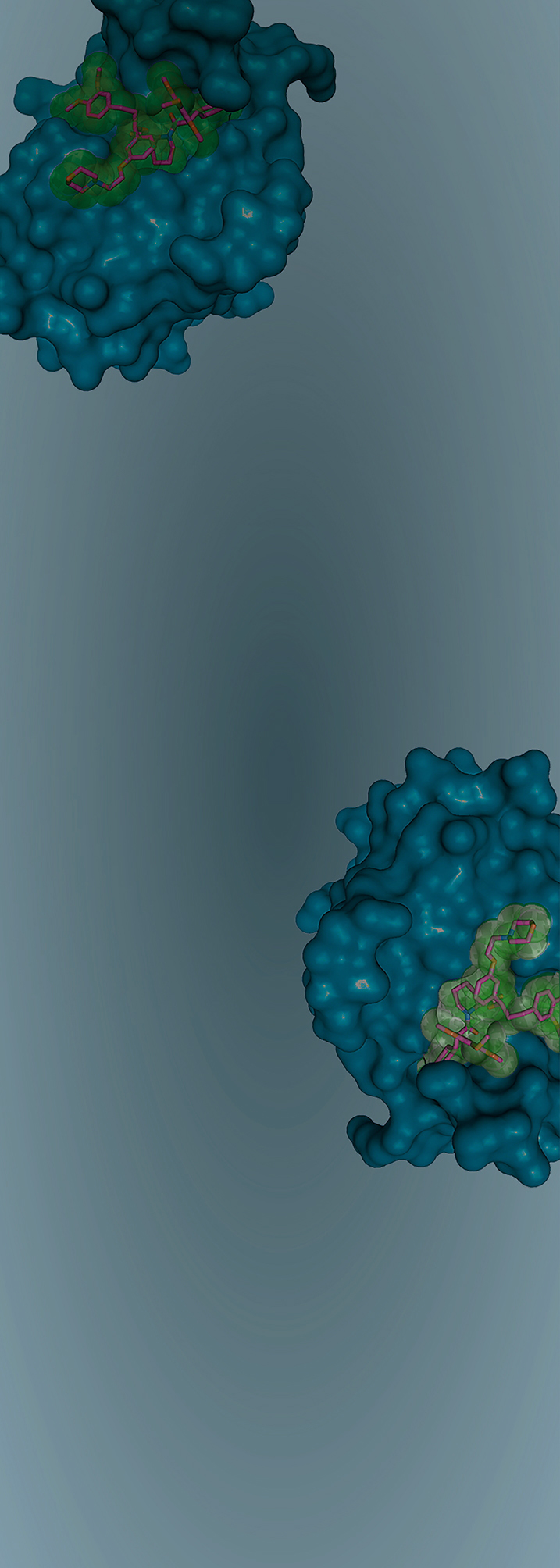
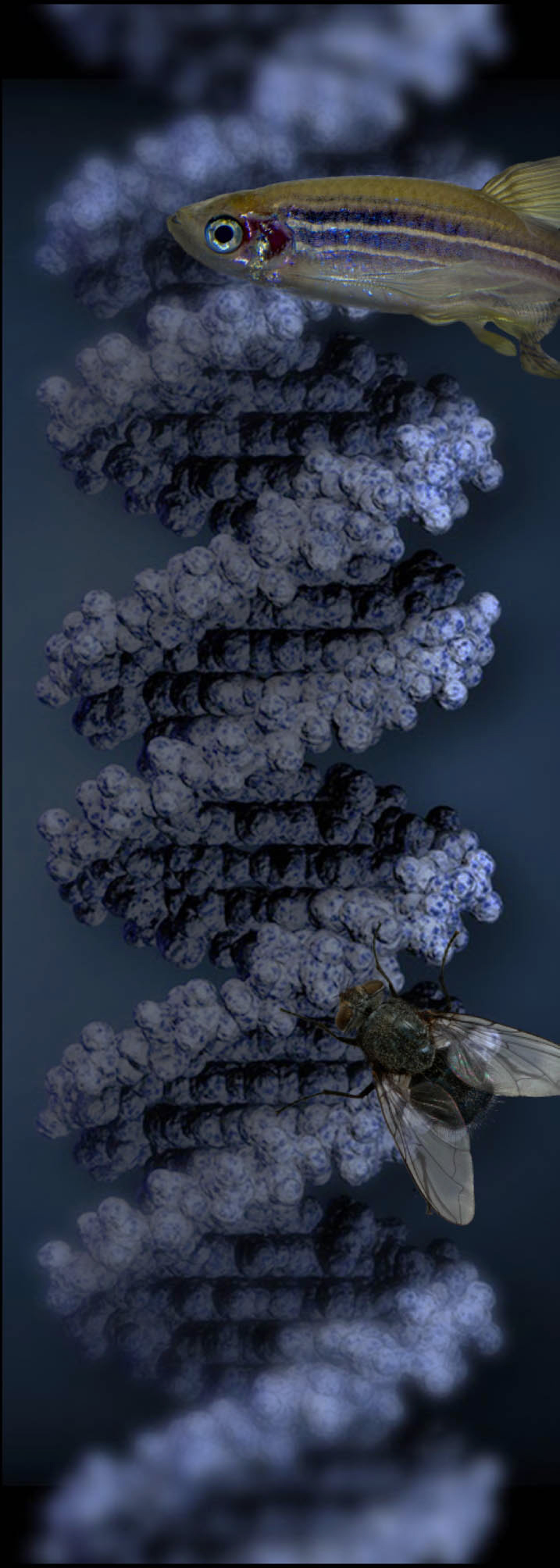
Grundlagenforschung erweitert Wissen. Erst wenn Komponenten und Funktionen eines Organs, Gewebes oder Zellverbands bekannt und verstanden sind, können gezielt Ansätze für effektive und nebenwirkungsarme Therapien entwickelt werden.
Wenn möglich, werden Ergebnisse ohne Versuchstiere mit Hilfe von Alternativmethoden gewonnen. Nicht-invasive Verfahren haben jedoch meist nur eine geringe Auflösung. So lassen sich die komplexen Interaktionen von Nervenzellen untereinander und mit ihrer Umgebung, sowie ihr Einfluss auf Verhalten meist nur mit Hilfe eigens dafür gezüchteter Versuchstiere klären. Neue Methoden und das verbesserte Wissen ermöglichen es heute wichtige Erkenntnisse zum Beispiel auch durch Studien an Fliegen zu gewinnen. An Hunden, Katzen oder Affen wird an den Instituten nicht geforscht.
Albert Herz und sein Team erforschten ab den 1960er Jahren die Funktion und Wirkmechanismen von Opium und Opioiden an Mäusen und Ratten. Sie identifizierten bis dahin unbekannte Opioide, fanden wo und wie die Stoffe im Gehirn wirken und zeigten, wie die Vorgänge durch Pharmaka, Stress oder Schmerz beeinflusst werden. Heute sind die Erkenntnisse Teil der modernen Schmerztherapie (Morphium), der Suchttherapie (Methadon) und dienen der Einschätzung des Suchtpotentials von Schmerzmitteln.
Ende der 1980er Jahre erforschte Werner Risau mit Axel Ullrich und Kollegen am Max-Planck-Institut für Biochemie Wachstumsfaktoren, die die Blutgefäßbildung fördern. Sie fanden, dass kleine Tumoren einen Faktor ausbilden, der das Wachstum von Blutgefäßen anregt und so das Tumorwachstum fördert. In den 1990er Jahren fanden die notwendigen Tierversuche an Mäusen in den USA statt. Aus den Ergebnissen entstand das hoch effektive Krebstherapeutikum (SUTENT®), das 2006 auf den Markt kam.
Hartmut Wekerle und sein Team untersuchen die grundlegenden Ursachen der Multiplen Sklerose (MS), der häufigsten Autoimmunerkrankung des zentralen Nervensystems. In den 1980er Jahren entwickelten sie ein Tiermodell der Ratte, in dem autoagressive T-Zellen eine MS-ähnliche Krankheit hervorrufen. Mit Hilfe dieses Tiermodells konnten kalifornische Forscher weitere Mechanismen der Krankheit aufklären, was 2006 zur Zulassung von TYSABRI® führte, dem derzeit wirksamsten Medikament bei schubförmig verlaufender MS.